1/ Réponses de l’épithélium respiratoire humain aux stress environnementaux particulaires (Armelle Baeza (resp.), Sonja Boland, Stéphanie Devineau, Francelyne Marano (émérite)).
Les activités humaines (industries, transports) et en particulier l’utilisation des nanotechnologies entraînent un accroissement de l’exposition des populations aux polluants particulaires atmosphériques ainsi qu’aux nanomatériaux manufacturés. Les cellules épithéliales qui tapissent l’appareil respiratoire, cibles des particules inhalées, développent des réponses spécifiques à ce type d’exposition.
Nos recherches visent à relier la nature des réponses biologiques observées avec certaines caractéristiques physico-chimiques des particules (composition chimique, taille, surface spécifique, réactivité de surface, cristallinité, forme, potentiel oxydant…). Nous nous intéressons aux nanoparticules manufacturées mais aussi à celles produites de façon non intentionnelle par des processus de combustion (moteur diesel, feux de cheminée) ou d’usure (plaquettes de freins).
Nous cherchons à mieux comprendre les mécanismes cellulaires et moléculaires induits par ces particules et en particulier, leur capacité à générer un stress oxydant associé ou non à leurs propriétés oxydantes intrinsèques.
![<multi> [fr] Particules ultrafines et nanoparticules manufacturées [en] Ultrafine particles and engineered nanoparticles </multi>](https://bfa.u-paris.fr/equipe-6/wp-content/uploads/sites/7/2017/01/png_Fig1_NP_EN.png)
![<multi> [fr] Particules et stress oxydant [en] Particles and oxidative stress </multi>](https://bfa.u-paris.fr/equipe-6/wp-content/uploads/sites/7/2017/01/png_Fig2_ROS_mechanism_EN-3.png)
Le stress oxydant peut activer des cascades de signalisation pouvant conduire à des réponses adaptatives ou à la mort cellulaire. Nous nous intéressons également au nucléole, domaine du noyau cellulaire dédié à la biogenèse des ribosomes et considéré comme un senseur de stress cellulaires.
Nous privilégions des approches in vitro afin d’étudier l’effet direct des particules sur les cellules épithéliales respiratoires en utilisant des lignées ainsi que des cultures primaires d’épithélium bronchique humain. Ces dernières sont capables de se différencier in vitro et de développer un épithélium muco-ciliaire qui peut être conservé plusieurs mois en culture et donc faire l’objet d’études d’expositions répétées à faibles doses et d’effets à long terme.
Les travaux de l’équipe portent en particulier sur :
![<multi> [fr] Travaux de l’équipe [en] Team research </multi>](https://bfa.u-paris.fr/equipe-6/wp-content/uploads/sites/7/2017/01/png_Fig3_Team_research_EN.png)
- les mécanismes d’internalisation et de passage des particules à travers la barrière épithéliale respiratoire
- l’étude des réponses adaptatives (telles que l’induction de défenses anti-oxydantes et de réponses pro-inflammatoires) et de la mort cellulaire induite par les particules et les voies de signalisation cellulaire impliquées.
- l’effet des particules sur les fonctions de réparation et de protection de la barrière épithéliale et leur impact sur la différenciation de l’épithélium respiratoire en exploitant les approches –omiques notamment sur le sécrétome épithélial
- La modulation de ces différents effets par l’interaction des particules non seulement avec des biomolécules (lipides, protéines) formant une corona autour de la particule mais également avec des xénobiotiques.
Nos travaux de recherche visent à contribuer à l’établissement d’AOP (« Adverse outcome pathways » pour « voies des effets indésirables ») tant par l’élucidation des mécanismes d’action que par le développement de modèles cellulaires 3D.
2/ Stress cellulaire et nucléolaire (Pascal Roussel, Valentina Sirri-Roussel)
Nous étudions le rôle de la sirtuine 7 (SIRT7), déacétylase nucléolaire NAD+-dépendante, dans la synthèse des sous-unités ribosomiques. Nous avons montré que l’activité de SIRT7 est un régulateur majeur de la maturation des pré-ARNr 45S, 32S et 30S.
Nous avons démontré que les naphtoquinones ménadione et plumbagine inhibent SIRT7 in vitro et in vivo. Nous avons également établi que l’arylation des sulfhydryles par la ménadione ou la plumbagine pouvait être empêchée par l’agent thiol réducteur N-acétyl-L-cystéine, avec un blocage concomitant de l’inhibition de l’activité catalytique de SIRT7. Cette inhibition de SIRT7 pourrait être cruciale pour établir l’action anti-tumorale de la ménadione ou de la plumbagine.
3/ Enzymes, environnement, pathologie moléculaire (Linh-Chi Bui, Florent Busi, Frédérique Deshayes, Jean-Marie Dupret (resp.), Emile Petit, Justine Renault, Fernando Rodrigues-Lima (resp.), Mireille Viguier).
Nous cherchons à caractériser aux niveaux moléculaire et fonctionnel les interactions entre xénobiotiques et voies enzymatiques.
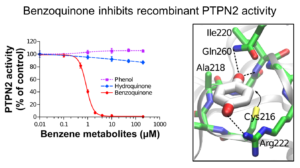
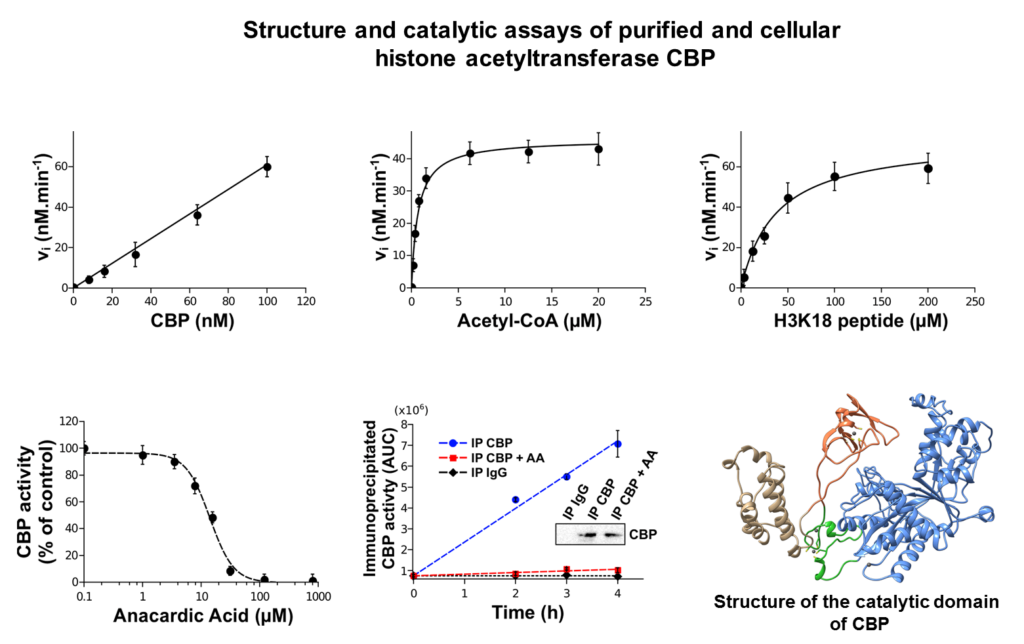
Nos travaux portent principalement sur l’impact de composés leucémogènes (benzène, étoposide,…) sur la tyrosine phosphatase PTPN2, l’histone acétyltransférase CREBBP et l’histone méthyltransférase SETD2.
Nous étudions également les impacts structuraux, moléculaires, et fonctionnels de mutations pathologiques (notamment oncogènes) affectant ces enzymes.
PTPN2, CREBBP et SETD2 jouent un rôle clé dans la signalisation cellulaire et les processus épigénétiques et il a été montré qu’elles sont impliquées dans l’hématopoïèse normale et maligne. Nous avons établi, grâce à différentes approches moléculaires et cellulaires que certains métabolites quinoniques leucémogènes altèrent de manière irréversible les fonctions de ces enzymes. Ces effets, qui sont le résultat de la modification covalente de cystéines à rôle catalytique ou structural, ont un impact sur la signalisation cellulaire et sur la modification épigénétique des histones. En parallèle, nous avons mené des approches structurales et enzymatiques qui nous ont permis de caractériser, pour la première fois, la structure d’un mutant pathogène de PTPN2 (C216G) ainsi que l’impact fonctionnel de cette mutation.