Axe 1 : Impact de l’état métabolique sur la signalisation multisensorielle.
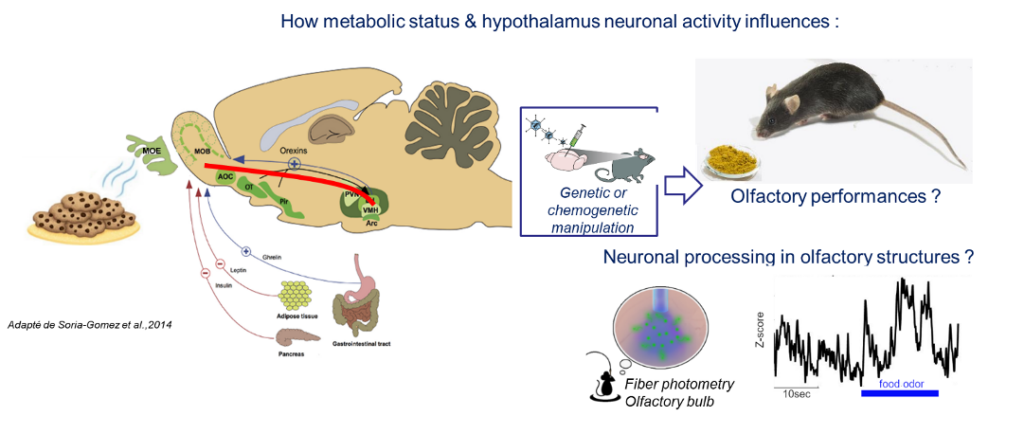
La prise alimentaire est une expérience fortement multisensorielle qui associe odeur, goût et toucher. L’odeur, l’un des indices sensoriels les plus pertinents pour prédire la présence de nourriture, est susceptible de jouer un rôle clé dans le choix et la consommation des aliments. En outre, la plupart des odorants activent également le nerf trijumeau, qui fait partie de la voie somatosensorielle. On ignore actuellement si des changements fonctionnels dans l’activation du nerf trijumeau pourraient être impliqués dans l’altération de l’olfaction chez les personnes obèses. Plusieurs études ont montré que le système olfactif est à la croisée des chemins entre le traitement sensoriel et la détection métabolique (Faour et al., 2022, Neuropharmacology 206, 108923). Le bulbe olfactif détecte et est modulé par les principales hormones et nutriments impliqués dans la régulation de la prise alimentaire. Cependant, nous ignorons encore l’impact de la région du cerveau qui exerce un contrôle majeur sur la prise alimentaire, l’hypothalamus, sur l’activité olfactive et le comportement alimentaire induit par l’olfaction. Notre hypothèse est que le réseau hypothalamo-olfactif module la qualité et/ou la valeur de récompense d’un odorant en fonction de l’état interne.
Nous combinons des approches comportementales et génétiques (souris transgéniques, Designer Receptors Exclusively Activated By Designer Drugs) et l’imagerie de biosenseurs fluorescents (photométrie fibrée basée sur le GCaMP) chez des souris en comportement pour évaluer l’impact de la manipulation des neurones AgRP ou l’impact de l’inhibition du nerf trijumeau sur l’activité neuronale du bulbe olfactif et le comportement alimentaire olfactif.
Financements : ANR Idex Emergence, Cooperation CNRS-UChicago (80Prime PhD fellowship), ANR HypoCamK, METABRAIN
Resources Humaines : Claire Martin (CM), Maya Four (MF), Julien Castel (JC), Serge Luquet (SL), Giuseppe Gangarossa (GG)
Axe 2 : Contrôle astrocytaire du métabolisme et de la réactivité en réponse à l’obésité
La surcharge nutritionnelle et l’obésité conduisent à une réponse adaptative de la physiologie des astrocytes, entraînant une altération du contrôle central de la prise alimentaire, de la dépense énergétique et du métabolisme du glucose (Garcia-Caceres et al., 2019, Nature neuroscience 22, 7-14.).
Nous avons caractérisé les altérations des propriétés structurelles et fonctionnelles des astrocytes et de la communication astrocyte-neurone et découvert que les astrocytes hypothalamiques du noyau paraventriculaire exercent un contrôle direct sur la régulation du poids corporel et le métabolisme du glucose (Herrera Moro Chao et al., 2022 Cell Metab 34, 1532-1547 e1536)).
Dans le striatum, nous avons montré que l’activation des astrocytes du striatum dorsal restaurait les déficiences cognitives induites par l’obésité et conduisait à un rétablissement de la synchronisation neuronale striatale. D’autre part, l’activation des astrocytes dans le Nucleus Accumbens modifie l’utilisation des substrats et la dépense énergétique du corps entier (Montalban et al 2023, BioRxiv https://www.biorxiv.org/content/10.1101/2023.03.21.533596v1).
Nous voulons aller plus loin dans l’examen du profil cellulaire et moléculaire des astrocytes en réponse adaptative à la DIO. Nous étudions l’impact de la communication astrocyte-astrocyte et astrocyte-neurone in vivo en utilisant des outils pharmacologiques et génétiques, y compris la manipulation DREADD/chimiogénétique de la signalisation Gq/Gi. Ces outils sont couplés à l’enregistrement in vivo de l’efficacité métabolique et de l’activité astrocytaire et neuronale (photométrie fibrée / GCaMP).
Financements : ANR AstrObesity.
Ressources humaines : Serge Luquet (SL), Claire Martin (CM), Caroline Leger (CL), Julien Castel (JC), Anthony Ansoult (AA), Giuseppe Gangarossa (GG) + partenaires.
Axe 3 : Déterminants moléculaires de la susceptibilité/résilience du cerveau à l’alimentation et aux maladies métaboliques.
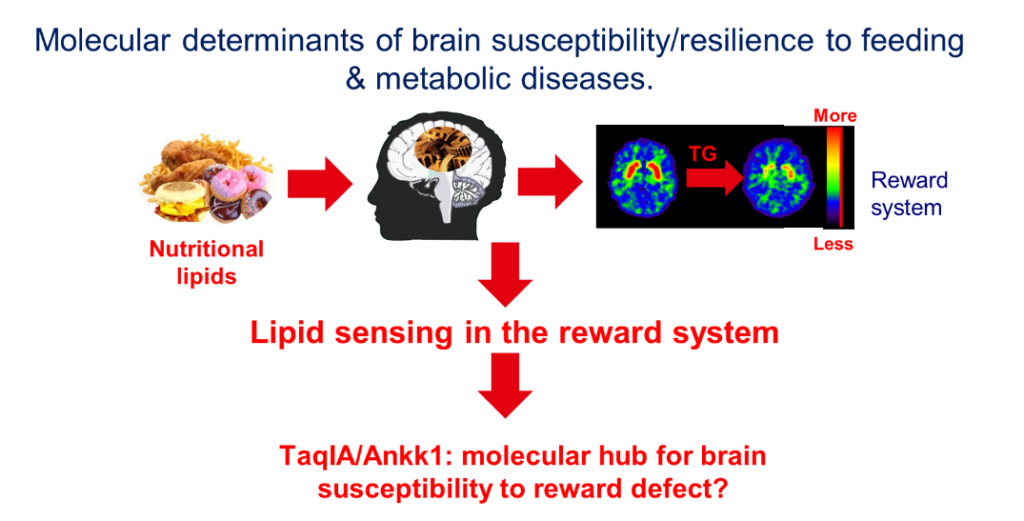
Nos études récentes montrent que les triglycérides circulants (TG) peuvent être métabolisés dans le système de récompense dopaminergique (DA) et moduler les comportements associés à la récompense en modulant l’activité des neurones exprimant le récepteur DA de type 2 (D2R) (Berland et al, 2020, Cell Metab 31, 773-790 e711. ; Berland et al., 2021, Trends Endocrinol Metab 32, 693-705. ; Cansell et al., 2014, Molecular psychiatry 19, 1095-1105.). De plus, chez l’homme, nous avons observé que l’excursion post-prandiale des TG était corrélée aux activités cérébrales déclenchées par les signaux alimentaires. De plus, nous avons observé que chez l’homme, l’effet modulateur des TG sur la réponse centrale était dépendant de l’intégrité de la signalisation D2R, et influencé par le polymorphisme TaqIA/Ankk1 (une mutation répandue associée à une dérégulation de la signalisation des D2R). Ces résultats dévoilent un nouveau mécanisme par lequel les TG alimentaires modifient directement les événements de signalisation, fournissant ainsi une nouvelle base mécanistique par laquelle les régimes riches en énergie conduisent à des comportements de type addictif/compulsif (Berland et al., 2020, Cell Metab 31, 773-790 e711. ; Sun et al., 2017, Trends Cogn Sci 21, 372-384.). Notre objectif est maintenant (1) d’explorer les mécanismes cellulaires et moléculaires par lesquels les lipides circulants altèrent la transmission dopaminergique et (2) de fournir un mécanisme moléculaire par lequel le polymorphisme TaqIA/Ankk1 conduit à la susceptibilité aux défauts métaboliques.
Méthodologie. Nous utiliserons à la fois l’administration de TG spécifiques au cerveau chez des souris contrôle et obèses pour explorer comment l’environnement obésogène affecte la fonction et l’excitabilité des circuits dopaminergique en réponse à des indices alimentaires, en combinaison avec des enregistrements in vivo (photométrie fibrée) des neurones dopaminergiques et exprimant le D2R à l’aide de biosenseurs de DA et de Ca2+. Nous évaluons comment la détection des lipides dans le cerveau affecte le choix des aliments, le renforcement alimentaire et l’efficacité métabolique (Berland et al., 2020, Cell Metab 31, 773-790 e711. ; Berland et al., 2021, Trends Endocrinol Metab 32, 693-705 chez des souris contrôle et obèses). Au niveau moléculaire, nous explorons les altérations transcriptomiques spécifiques à un sous-type cellulaire après l’administration de TG et/ou un régime obésogène.
Le Polymorphisme TaqIA/Ankk1 et dysfonctionnement de la récompense.
Le polymorphisme TaqIA A1 (SNP, rs1800497) est situé dans le gène codant pour la kinase ANKK1 (Ankyrin repeat and kinase domain containing 1 kinase) près du gène Drd2. Le SNP TaqI est le polymorphisme le plus étudié dans les maladies psychiatriques mais, à part des études corrélatives chez l’homme, il n’y a pas de mécanisme décrit quant au rôle d’ANKK1 (revue voir (Sun et al., 2017, Trends Cogn Sci 21, 372-384)).
Nous avons développé une lignée de souris Ankk1fl/fl et étudié les conséquences de l’ablation d’Ankk1 dans les circuits de la récompense. Nous avons découvert qu’Ankk1 contrôle la récompense et le métabolisme par la régulation de l’activité des neurones exprimant le D2R (Montalban. E et al. 2023. Bio Psy). A ce jour nous avons aussi développé un modèle murin dans lequel la mutation d’Ankk1 a été introduite par CRISPR/Cas9. Ce modèle nous permet d’identifier les mécanismes moléculaires potentiels par lesquels les variantes A1 et A2 d’Ankk1 pourraient affecter l’activité neuronale du réseau de la récompense.
Résultats attendus. 1-Caractériser et identifier les adaptations moléculaires déclenchées par l’exposition chronique aux TG dans le système de récompense. 2-Déterminer si et comment les TG alimentaires peuvent altérer la fonction et l’excitabilité des circuits neuronaux mésolimbiques. 3-Déterminer le rôle d’Ankk1 dans l’adaptation des circuits neuronaux mésolimbiques/hypothalamiques. 4-Déterminer la base moléculaire par laquelle Ankk1 A1/A2 modifie la signalisation D2R/DA.
Financements : Ce projet est principalement financé par le Modern Diet and Physiology Research Center (MDPRC), labellisation équipe FRM 2020, la Fondation pour la recherche sur le Cerveau, la Fondation Allen, Nutricia Research Foundation, et en partie par l’ANR. Le soutien institutionnel à la mise en place du réseau collaboratif franco-américain est financé par le projet de recherche international (IRP) BRAINHEALTH du CNRS.
Ressources humaines : Serge Luquet (SL), Giuseppe Gangarossa (GG), Claire Martin (CM), Julien Castel (JC), Guangping Li (GL), Anthony Ansoult (AA), Fanny Bain (FB), Caroline Leger (CL), Nour Mesto (NMe), Claudia Grajeda (CG) + partenaires.
Axe 4 : Dynamique intéroceptive contrôlant les processus homéostatiques et de récompense
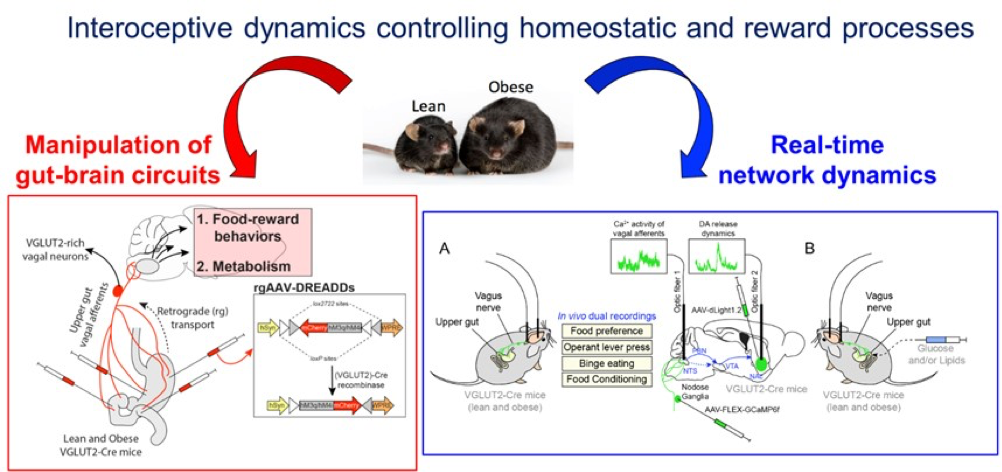
Introduction. Les signaux intéroceptifs provenant de la périphérie, via le nerf vague, informent constamment le cerveau des états physiologiques des organes périphériques, régulant ainsi l’activité des circuits cérébraux et influençant l’élaboration de stratégies adaptatives orchestrées par le cerveau. Récemment, nous avons démontré que les endocannabinoïdes périphériques ambiants (eCB) régulent de manière bidirectionnelle l’activité de l’axe vagal intestin-cerveau (Berland et al., 2022, Mol Psychiatry 27, 2340-2354.) et contribuent à l’établissement des troubles alimentaires liés à la récompense. De plus, nous avons également découvert que les informations intéroceptives et homéostatiques peuvent être relayées entre les régions cérébrales en aval (tronc cérébral) et les régions cérébrales en amont en mobilisant le réseau étendu du thalamus paraventriculaire (PVT) (Dumont et al., 2022 JPhysiol). Notre hypothèse actuelle repose sur l’idée qu’une plasticité maladaptée du nerf vague et une distorsion de la trajectoire intéroceptive peuvent conduire à la dysrégulation des centres neuronaux de l’axe « étendu » intestin-cerveau et favoriser les troubles de l’alimentation (c’est-à-dire l’obésité).
Méthodologie. Tout d’abord, nous évaluerons si et comment l’obésité perturbe fonctionnellement les réseaux neuronaux interconnectés et la dynamique permettant l’intégration des informations intéroceptives et l’élaboration de réponses (mal)adaptées. Nous étudierons principalement de nouvelles trajectoires intéroceptives intestin-cerveau qui, en convergeant sur différents réseaux, aboutissent à la régulation de la valence alimentaire (c’est-à-dire le renforcement, la récompense), notamment la voie nerf vaguetronc cérébralNAc et son centre intermédiaire le PVT. En utilisant des approches spécifiques aux projections et aux types cellulaires, nous utiliserons la photométrie fibrée pour enregistrer in vivo simultanément l’activité du Ca2+ et la dynamique de libération de médiateurs (dopamine, acétylcholine, GLP-1, glutamate) au niveau de plusieurs segments de l’axe intestin-cerveau. Les trajectoires intéroceptives seront étudiées pendant l’alimentation spontanée/provoquée, la préférence alimentaire, les comportements motivés par la nourriture et l’administration intragastrique de nutriments chez les souris contrôle et obèses. Ensuite, nous utiliserons des micro-injections restreintes aux réseaux interconnectés de virus Cre/Flp-dépendants exprimant des récepteurs modifiés (Gq, Gi, NaChBac, Kir2.1) pour manipuler les composantes neuronales de l’axe intestin-cerveau dans les processus de récompense alimentaire, de métabolisme énergétique et de prise de poids. Encore une fois, notre analyse fonctionnelle se concentrera au niveau du réseau nerf vaguetronc cérébralNAc et son centre intermédiaire le PVT. Enfin, au niveau moléculaire, nous explorerons comment l’environnement obésogène conduit à des (mal)adaptations transcriptomiques des réseaux neuronaux constituant l’axe « étendu » intestin-cerveau par l’utilisation de méthodologies spécifiques aux projections et/ou aux sous-types cellulaires.
Résultats attendus. Ce travail permettra de dévoiler les circuits interconnectés ainsi que les mécanismes cellulaires et moléculaires par lesquels les signaux intéroceptifs générés par l’intestin et médiés par le nerf vague contribuent à la (dys)régulation des réseaux neuronaux et au déclanchement des troubles de l’alimentation liés à la récompense, au maintien du poids corporel et au métabolisme énergétique.
Financements : Ce projet est principalement financé par l’ANR JCJC HERO, l’ANR ParObesity, le FRC-Gangarossa, la Nutricia Research Foundation, l’IReSP, Idex Emergence ThalHOME, l’IUF, FRM et partiellement par le financement Bariatek.
Ressources humaines : Giuseppe Gangarossa (GG), Oriane Onimus (OO), Benoit Bertrand (BB), Nejmeh Mashhour (NMa), Camille De Almeida (CdA), Julien Castel (JC), Serge Luquet (SL), Claire Martin (CM) + partenaires.