Nos recherches s’articulent autour des thèmes suivants:
1. Prolifération, Différenciation et Régénération des Cellules beta pancréatiques (Jamileh Movassat)
Nous nous intéressons actuellement aux rôle des voies de signalisation Wnt/ beta-caténine et Notch/Delta dans la régulation de la prolifération et de la néogénèse des cellules beta dans les conditions normales, ainsi qu’au cours de situations de croissance compensatrice nécessaire pour faire face aux besoin accrus de l’organisme en insuline dans certains contexte physiologiques (la gestation) ou pathologique (l’insulinorésistance). Notre groupe a une grande expertise dans l’étude de la régénération beta cellulaire et développe des approches innovantes visant à induire la régénération in situ des cellules beta, notamment par l’activation de la différenciation des cellules précurseurs intra-pancréatiques en cellules beta.
2. Le déficit de l’exocytose de l’insuline au cours du diabète de type 2 (Cécile Tourrel-Cuzin)
La pathophysiologie de la sécrétion réduite d’insuline dans le diabète de type 2 reste toujours mal comprise mais certains arguments cliniques et expérimentaux montrent l’implication des étapes distales de l’exocytose d’insuline par la cellule beta pancréatique. Ces étapes distales impliquent deux partenaires: le cytosquelette d’actine en région sous-corticale et les protéines SNAREs qui régulent l’accostage des granules de sécrétion et leur fusion avec la membrane plasmique en réponse à un stimulus externe, tel que le glucose. Les interactions entre le réseau filamenteux d’actine et les protéines SNAREs sont cruciales pour l’activation optimale de cette exocytose en réponse au glucose.
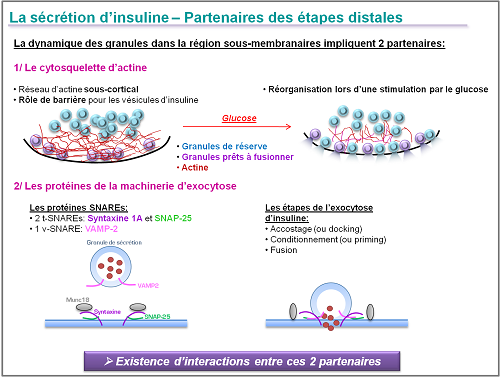
Les objectifs de notre recherche sont les suivants:
1/ Compréhension des mécanismes moléculaires contrôlant l’exocytose de l’insuline
En utilisant une combinaison d’approches moléculaires et cellulaires (imagerie sur cellules vivantes – TIRFM) nous nous intéressons à l’expression et la fonctionnalité des acteurs moléculaires majeurs qui régulent l’exocytose d’insuline, en nous focalisant tout particulièrement sur les interactions entre les protéines SNAREs et le réseau sous-cortical d’actine dans la cellule β pancréatique saine ou diabétiques. Cette approche nous permet de mieux comprendre l’étiologie des dysfonctionnements de l’exocytose dans la cellule beta pancrétique soumise à un environnement diabétiques.
2/ Approches thérapeutiques cellulaires par correction des dysfonctionnements de l’exocytose dans la cellule β
Nous avons récemment montré qu’il était possible de restaurer in vitro la sécrétion d’insuline en réponse au glucose, grâce à une exposition aiguë des îlots GK au GLP-1, activateur des voies de signalisation dépendantes de l’AMPc (Dolz et al, Diabetes 2005). Nous avons donc mis en place un projet qui s’intéresse à l’influence des voies AMPc PKA-dépendantes et/ou Epac2-dépendantes sur les étapes distales de l’exocytose d’insuline dans la cellule beta pancréatique.
3.a Perturbations du métabolisme énergétique dans la cellule beta pancréatique diabétique (Marie-Hélène Giroix)
Dans des modèles de DT2 induit (rat n0-STZ) ou spontané (rat GK), nous avons été parmi les premiers à mettre en évidence comme facteurs causaux du dysfonctionnement sécrétoire des cellules beta plusieurs perturbations métaboliques intrinsèques des cellules insulaires (e.g. glycolyse aérobie et production d’ATP, métabolisme et composition en acides gras des phospholipides altérés). Les recherches se poursuivent et diverses approches pharmacologiques sont testées pour contrecarrer les anomalies détectées et ainsi améliorer/restaurer la sécrétion d’insuline.
b/ Emergence du DT2 et mise en place de systèmes d’adaptation/protection chez le rat GK
L’analyse du rat GK a été entreprise à différents stades de son développement (1) fœtus (soumis à l’hyperglycémie/hyperlipidémie maternelles), (2) nouveau-né prédiabétique (normoglycémique), (3) adulte diabétique (hyperglycémique). D’ores et déjà, il ressort que toute une série de paramètres sont altérés chez le rat GK avant l’apparition des signes cliniques du DT2. Notamment, les fœtus et/ou nouveau-nés présentent: (1) au niveau systémique, une hypercholestérolémie (facteur reconnu de risque athérogène) et des marqueurs d’inflammation, (2) au niveau pancréatique, un défaut de vascularisation et des signes de microangiopathie et d’angiogénèse déficiente, ce qui a certainement un impact négatif sur non seulement le développement des îlots et la masse beta cellulaire mais aussi sur leur maturation fonctionnelle; (3) au niveau du foie: une altération de l’expression génique et l’activité de protéines impliquées dans le métabolisme du cholestérol (collaboration avec N. Janel dans l’équipe 5 (Resp. J.-M. Delabar) de BFA. Nos données orientent vers la piste du rôle déterminant d’anomalies précoces affectant le métabolisme lipidique hépatique et la vascularisation des îlots pancréatiques dans la programmation in utero et/ou l’installation du DT2 chez les rats GK. Elles révèlent aussi la mise en place, de différentes manœuvres (e.g. surexpression pancréatique de gènes/protéines Reg) pour lutter contre l’environnement diabétique délétère.


