Applications et Services
Contact : Cécile Tourrel-Cuzin
Toutes les techniques de cytométrie en flux sont réalisables dans la mesure où les lasers et la configuration des filtres optiques du cytomètre sont compatibles avec les fluorochromes utilisés.
1/ l’analyse des constituants cellulaires:
ADN (étude du cycle cellulaire, viabilité, prolifération…)
ARN
protéines
Phénotypage: expression d’antigènes membranaires et/ou intracellulaires.
2/ l’analyse de fonctions cellulaires:
Flux ioniques (Calcium…)
modification du pH
variation du potentiel membranaire ou mitochondrial
apoptose (mesure Annexine V/Iodure de propidium)
cytokines et activités enzymatiques.
3/ l’analyse de cellules transfectées
EGFP
mCherry…
Toutes ces mesures peuvent être associées entre elles et dans certains cas accompagnées d’un tri cellulaire.
La liste ci-dessus n’est pas une liste exhaustive : nous pouvons vous aider à élaborer des protocoles de recherche (choix des fluorochromes, conditions de tri et traitement des échantillons triés).
Quelques exemples d’applications
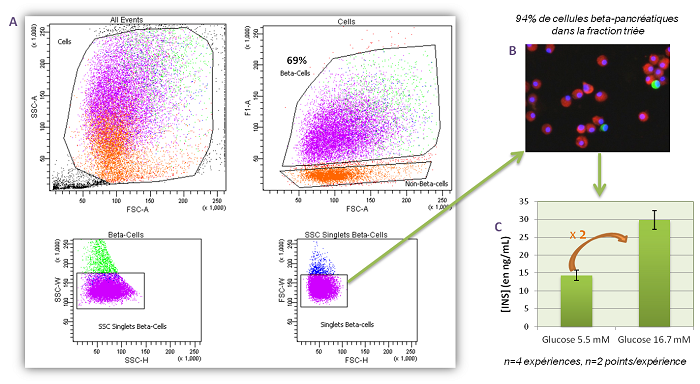
1. Tri de cellules beta pancréatiques primaires
• Tri de cellules beta-pancréatiques primaires de rat par cytométrie en se basant leur taille (FSC) et leur auto-fluorescence (F1), après élimination des doublets de cellules (Fig. A).
• Vérification de la pureté du tri par immuno-fluorescence après marquage des cellules avec des anticorps anti-insuline-RhodamineX et anti-glucagon-Alexa488 (Fig. B).
• Vérification de la fonctionnalité des cellules triées par dosage de l’insuline sécrétée en réponse à une concentration basale (5.5 mM) et stimulante en glucose (16.7 mM) (Fig. C).
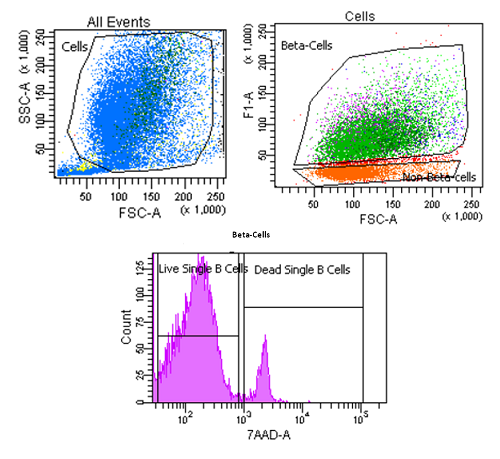
2. Analyse de la viabilité de cellules beta pancréatiques par marquage au 7-AAD
• Cellules beta pancréatiques primaires de rat marquées au 7-AAD (7-Amino-Actinomycin), marqueur de viabilité cellulaire qui s’intercalent dans la double hélice d’ADN.
Les cellules sont incubées pendant 10 min à raison de 0.1 µg de 7-AAD pour un million de cellules.
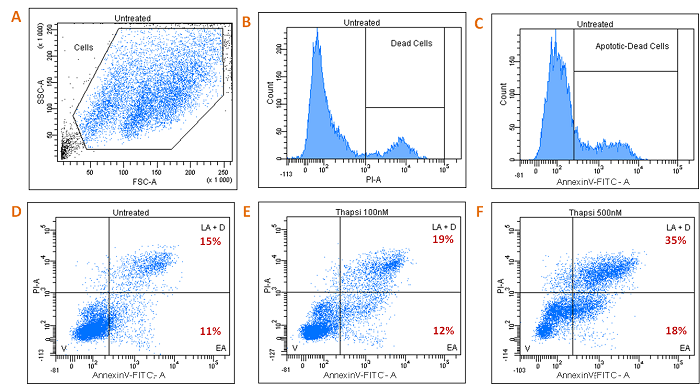
3. Analyse de la mort cellulaire et de l’apoptose
3.1/ Analyse de l’apoptose et de la mort cellulaire sur cellules INS-1
par co-marquage à l’Annexine V-FITC et à l’Iodure de Propidium (PI).
• Cellules INS-1 (lignée de cellules beta pancréatiques de rat) productrices d’insuline d’insuline, non traitées (Fig. A, B, C, D) ou traitées avec un inducteur d’apoptose, la Thapsigargine à 100 nM (Fig. E) ou 500 nM (Fig. F).
V: Viable Cells, EA: Early Apoptotic Cells, LA: Late Apoptotic Cells, D: Dead Cells.
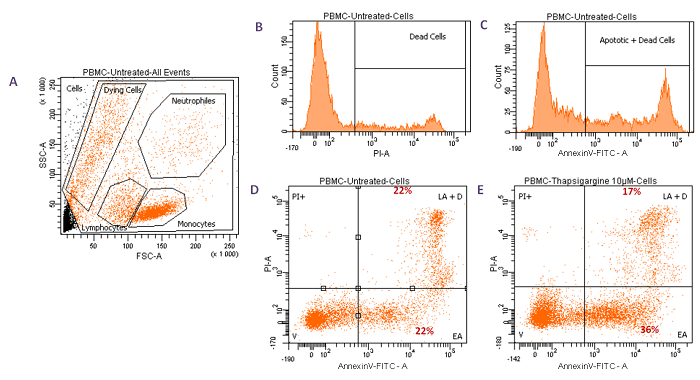
3.2/ Analyse de l’apoptose et de la mort cellulaire de PBMC
par co-marquage à l’Annexine V-FITC et à l’Iodure de Propidium (PI).
• Cellules Mononuclées du Sang Périphérique (PBMC) non traitées (Fig. A, B, C, D) ou traitées avec un inducteur d’apoptose, la Thapsigargine à 10 µM pendant 4H (Fig. E).
V: Viable Cells, EA: Early Apoptotic Cells, LA: Late Apoptotic Cells, D: Dead Cells.