Principe de la cytométrie en flux et du tri cellulaire
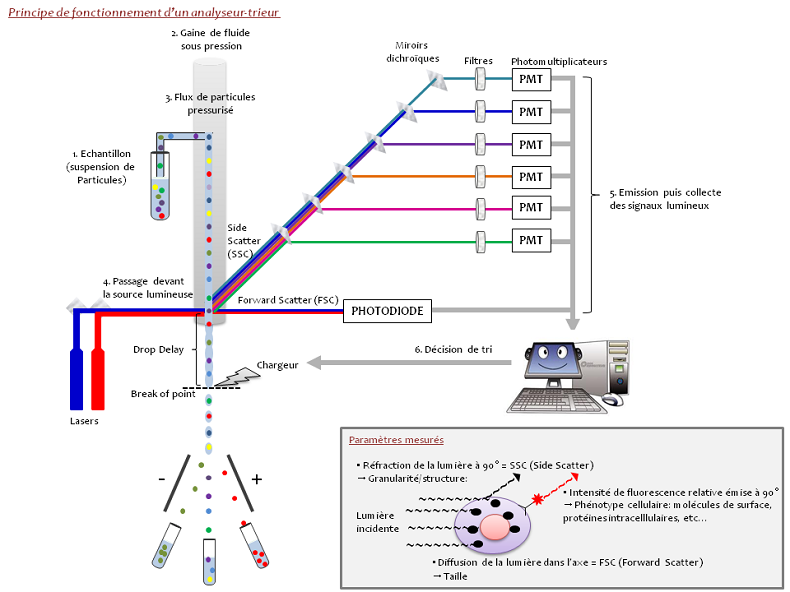
La cytométrie en flux est une technique qui permet de mesurer, sur une suspension de particules (cellules, bactéries, parasites, billes..), les caractéristiques individuelles de chaque particule telles que la taille, la forme et la complexité, et n’importe quel composant ou fonction qui puisse être détecté par un composé fluorescent.
Les cellules en suspension passent une à une devant un ou plusieurs faisceau(x) laser et des détecteurs captent des signaux émis par chaque cellule, tels que:
La lumière diffusée aux petits angles (Forward Scatter, FSC) qui renseigne sur la taille des particules
La lumière diffusée à 90 degrés (Side Scatter – SSC) qui renseigne sur la forme, la structure interne et la granularité des particules.
Les signaux de fluorescence
- Fluorescence émise par la cellule elle-même (autofluorescence)
- Fluorescence émise par un anticorps couplé à un fluorochrome et qui se lie spécifiquement à la cellule.
Les données ainsi recueillies se présentent sous forme de graphiques ou d’histogrammes auxquels s’ajoutent des statistiques concernant les populations cellulaires et les paramètres étudiés (%, CV, intensité de fluorescence, etc.). Le principal avantage de la cytométrie en flux est la vitesse d’acquisition des données pour un très grand nombre de cellules, permettant l’analyse de sous-populations cellulaires complexes et/ou rares et de les trier pour ensuite les mettre en culture ou encore les analyser avec des outils de biologie moléculaire.
Le tri peut être défini comme la séparation physique de cellules ou de particules d’intérêt à partir d’une population hétérogène. Les cellules ou particules sont aspirées de l’échantillon et injectées une à une par une buse dans un courant continu de tampon (type PBS). En appliquant au jet, une onde de vibration d’une fréquence et d’une amplitude déterminée, il va se rompre pour donner des gouttes à un point précis caractérisé par sa position et son temps d’apparition appelé « break of point ». Au moment de l’interception de la cellule avec le faisceau laser, la lumière déviée et la fluorescence émise génèrent un signal qui est traité par le programme de tri afin de décider si la cellule doit être isolée ou non selon les critères définis par l’utilisateur. La distance entre le point d’impact du laser avec la cellule et le « break of point » est appelée le « drop delay ». Si une cellule d’intérêt devant être triée a été détectée, le cytomètre attend qu’elle arrive jusqu’au « break of point » pour charger la goutte. Comme celle-ci contient la cellule à trier, en passant entre les plaques de déflection fortement chargées, elle est déviée du côté de la plaque de polarité opposée et collectée.
Le mode de tri peut être modifié pour choisir un maximum de pureté ou un maximum de rendement (pour une petite et précieuse population) ou un maximum de précision dans le comptage pour un clonage.
Equipement disponible
Applications et services


